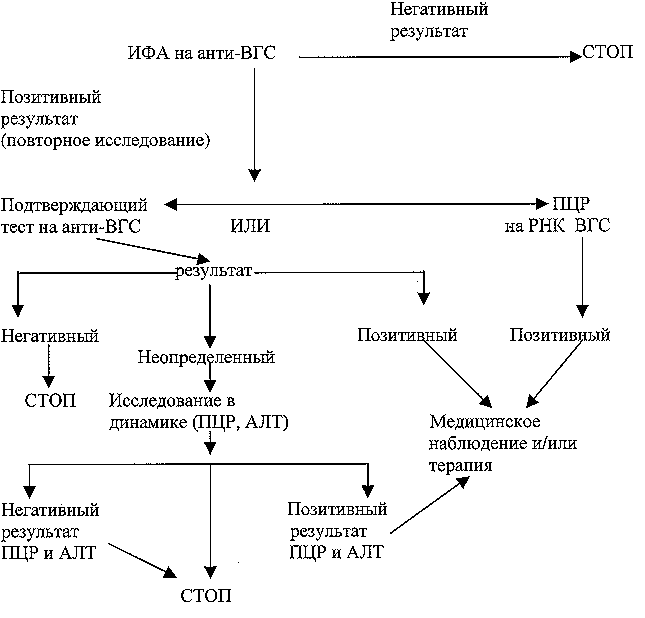
Гепатит СРоссийский консенсус по гепатиту СДанный документ является обобщенным мнением специалистов, занимающихся диагностикой, эпидемиологией, клиникой, лечением и профилактикой гепатита С, которые принимали участие в работе научно-практической конференции «Гепатит С (Российский консенсус)» 26-27 сентября 2000 г. в Москве. Это мнение рекомендуется учитывать при подготовке нормативных материалов и в практической работе. ГЕПАТИТ С (ДИАГНОСТИКА, ЭПИДЕМИОЛОГИЯ, ЛЕЧЕНИЕ, ПРОФИЛАКТИКА)В современный период в России имеет место резкая активизация эпидемического процесса гепатита С. Значительный рост показателей заболеваемости острым гепатитом С (3,2 на 100 тысяч населения в 1994 и 19,3 в 1999 году), частое поражение лиц молодого возраста, высокий уровень хронизации с возможным исходом в цирроз и первичный рак печени определяют повышенное внимание к этому заболеванию, актуальность и важность его дальнейшего изучения. 1. ВИРУС ГЕПАТИТА С. Вирус гепатита С (ВГС) – член семейства флавивирусов. Геном ВГС представлен однонитевой РНК протяженностью около 10.000 нуклеотидов. ВГС вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян (шимпанзе и др.). В сыворотке крови больного и вирусоносителя концентрация ВГС, как правило, не превышает 104 в мл., что значительно меньше соответствующих показателей при гепатите В (107 -1010 в мл) и определяет более высокую инфицирующую дозу ВГС по сравнению с вирусом гепатита В (ВГВ). Популяция ВГС крайне неоднородна. Идентифицировано 6 генотипов (классификация по Simmonds), более 90 субтипов и множественных вариантов вируса, обозначаемых как квазивиды. Зарегистрирована территориальная неравномерность циркуляции генотипов ВГС. В Российской Федерации чаще всего выявляют генотипы 1b и 3a этого вируса. Высокая изменчивость ВГС определяет трудности создания вакцины против гепатита С, которой пока нет. 2. ЛАБОРАТОРНАЯ ДИАГНОСТИКА ГЕПАТИТА С. Лабораторная диагностика гепатита С (ГС) основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться диагностическими препаратами отечественных или зарубежных производителей, разрешённых МЗ РФ, строго по инструкции, прилагаемой к набору, в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований. Алгоритм лабораторного обследования пациентов на наличие ВГС представлен на схеме №1. АЛГОРИТМ ОБСЛЕДОВАНИЯ ПАЦИЕНТОВ БЕЗ СИМПТОМОВ ПОРАЖЕНИЯ ПЕЧЕНИ на НАЛИЧИЕ ВГС-ИНФЕКЦИИ
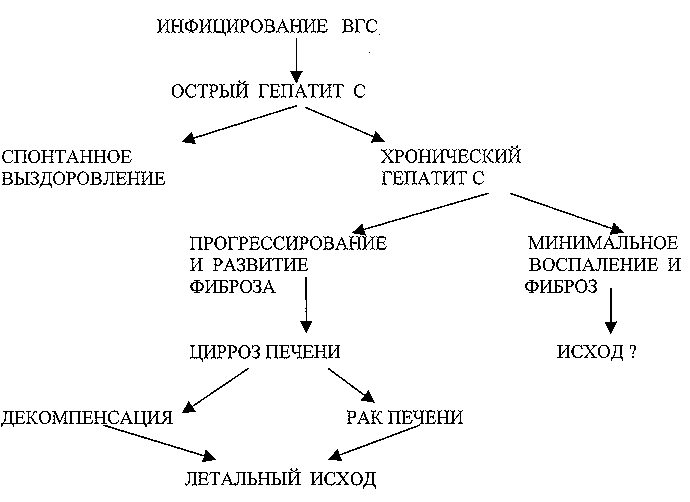
При получении положительного результата в ИФА необходимо использовать дополнительные подтверждающие диагностические препараты отечественного или зарубежного производства и ориентироваться в своем заключении на результаты исследования сывороток в указанных тестах. Результаты проведенных исследований могут трактоваться как: «позитивный», «негативный» и «неопределенный». При «неопределенном» результате через два и более месяцев должно быть проведено дополнительное исследование на наличие маркеров инфицирования ВГС. В качестве подтверждающего метода можно использовать ПЦР с целью выявления РНК ВГС при условии применения диагностических препаратов, одобренных МЗ РФ. Обнаружение РНК ВГС в сыворотках крови с анти-ВГС указывает на текущую инфекцию. Отсутствие РНК ВГС в анти-ВГС позитивных образцах крови не может быть использовано для разграничения прошедшего ГС и "ложнопозитивного" результата лабораторного исследования. Кроме того, у некоторых пациентов регистрируется неустойчивая виремия, что может определять негативный результат выявления РНК ВГС. Необходимость улучшения качества лабораторных исследований при выявлении маркёров инфицирования ВГС определяет обязательное участие лабораторий в системе мероприятий по осуществлению внешнего контроля качества. Для проведения данной работы необходима научнообоснованная разработка контрольных панелей для тестирования анти-ВГС и РНК ВГС. 3. ЭПИДЕМИОЛОГИЯ ГЕПАТИТА С и ПРОФИЛАКТИЧЕСКИЕ МЕРОПРИЯТИЯ. Источниками заражения ВГС служат больные острыми и хроническими формами ГС-вирусной инфекции, причем основное значение среди них имеют лица с отсутствием желтухи с бессимптомным или малосимптомным течением. Гепатит С – инфекция с парентеральной передачей возбудителя, проявляющаяся всеми известными формами инфекции – острыми и хроническими с манифестным или бессимптомным течением. Процесс развивается в основном латентно. В настоящее время большая часть манифестных заболеваний острым ГС является результатом заражения при проведении различных медицинских и немедицинских (в основном внутривенное введение психотропных препаратов) парентеральных манипуляций. Заражение гепатитом С при приеме наркотиков играет ведущую роль и определяет неодинаковую интенсивность эпидемического процесса в разных возрастно-половых группах. Наиболее интенсивно в эпидемический процесс вовлекаются подростки 15-17 лет и молодые взрослые 18-29 лет, преимущественно мужского пола. Среди них формируются специфические группы риска заражения вирусом ГС при многократном использовании контаминированных вируссодержащей кровью игл и шприцев с целью внутривенного введения психотропных препаратов – учащиеся средних (главным образом ПТУ) и высших учебных заведений, мелкие коммерсанты, лица, находящиеся в заключении, безработные и др. Группы риска формируются также из числа лиц, получавших по жизненным показаниям кровь и ее препараты – больные гемофилией, больные, страдающие хронической почечной недостаточностью и получающие сеансы гемодиализа, онкогематологические больные. К группам повышенного риска относятся лица, страдающие различными хроническими заболеваниями (туберкулез и др.) и получающие длительное и многократное стационарное лечение, персонал учреждений службы крови, стационаров (прежде всего сотрудники хирургических, реанимационных отделений, клинико-диагностических лабораторий), имеющие непосредственный контакт с кровью и содержащими кровь секретами, а также доноры, особенно доноры плазмы, подвергающиеся неоднократному неаппаратному плазмаферезу. Эпидемический процесс может проявиться локальными вспышками ГС в случае вовлечения в него значительного числа лиц из групп риска (локальные вспышки в стационарах, центрах плазмафереза и др.). Естественный компонент эпидемического процесса изучен недостаточно. Материалы эпидемиологического изучения семей больных острым и хроническим ГС подтверждают редкую возможность реализации полового пути передачи возбудителя. Более часто реализация этого пути имеет место среди лиц, ведущих беспорядочную половую жизнь, практикующих секс за деньги, подвергнутых сексуальному насилию, и т.д. Передача ВГС от матерей с острой или хронической формой инфекции – явление редкое, встречается не чаще 5-6 % случаев. Риск заражения указанными естественными путями уступает таковому при гепатите В (ГВ). Профилактические мероприятия в отношении путей и факторов передачи вируса ГС (в т.ч. в очагах хронических форм ВГС-инфекции) проводятся аналогично ГВ. Важное значение имеет медицинское образование населения с акцентами на путях передачи возбудителя ГС и мерах профилактики заражения. Универсальные меры профилактики заражения возбудителями инфекций, передающихся через кровь и половым путем (ГВ, ВИЧ-инфекция, венерические болезни) эффективны и при ГС. С целью защиты лиц больных хроническим гепатитом С, от возможного заражения ВГА и ВГВ рекомендуется их вакцинация против гепатита А и В. 4. ПОСТТРАНСФУЗИОННЫЙ ГЕПАТИТ С и СЛУЖБА КРОВИ Предупреждение пострансфузионного гепатита С – одна из наиболее актуальных задач Службы Крови (СК). Эта задача определяется тремя группами проблем, с которыми сталкивается сегодня СК страны. 4.1. Работа с донорским контингентом Существенное снижение качества жизни в новой России, ослабление государственной поддержки донорства и работы с населением привели к сокращению числа доноров и к устойчивой тенденции в сторону увеличения доли платных добровольцев, а также к общему увеличению возраста доноров и к практике найма доноров, выдаваемых за родственников. Выходом из этого положения может стать только возобновление эффективной пропагандистской работы СК (чем в СССР занимались, по преимуществу, организации Красного Креста). В настоящее время следует использовать любую возможность (например, в случаях природных катастроф, боевых столкновений и проч.) для демонстрации в средствах массовой информации и телекоммуникации (например, в Интернете) постоянной нехватки донорской крови. 4.2. Лабораторная диагностика Детекция маркеров гепатита С – одно из слабых мест лабораторной идентификации актуальных в СК вирусов. С одной стороны, отсутствие на рынке надежных систем прямого определения вирусных белков приводит к тому, что до сих пор результаты ИФА-тестирования на антитела к вирусу гепатита С (ВГС) остаются основой выбраковки потенциально опасной по ВГС-инфекции донорской крови в СК. С другой стороны, внедрение рутинной NAT-диагностики (т.е. методов тестирования на нуклеиновые кислоты, в т.ч. ПЦР) российской СК сейчас не под силу. Серьезными потерями оборачивается для СК и отсутствие централизованной компьютерной базы данных по донорам, создание которой является неотложной задачей. Представляется целесообразным скорейшее поэтапное внедрение методов ПЦР в практику СК. Финансовую поддержку этой работе может обеспечить производство препаратов крови. Кроме того, именно на производстве оказывается возможным экономически более выгодный, нежели индивидуальный, ПЦР-анализ пулированного сырья. Создание и работа ПЦР-лабораторий должны быть обеспечены независимым контролем, а их сотрудники обязаны пройти квалификационную подготовку и независимую оценку. В СК абсолютно необходима также организация централизованных компьютерных баз данных. 4.3. Производство вирусобезопасных препаратов крови Производство препаратов крови предполагает сегодня два эшелона противовирусной защиты: входной контроль и инактивацию на этапах фракционирования. Входной контроль соответствует той работе, которая проводится на станциях и отделениях переливания крови (п.4.2); инактивация осуществляется прогреванием полупродуктов и обработкой их детергентами и низкими рН; используется также нанофильтрация – для снижения концентрации возможного вируса перед инактивацией. Выходной контроль сегодня не регламентируется, поскольку его надежность ограничена полуколичественным характером ИФА и ПЦР и отсутствием адекватных и недорогих лабораторных систем прямого вирусологического исследования. Представляется целесообразным экспериментальное использование методов NAT для оценки их возможностей в организации выходного контроля производства препаратов крови. 5. ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ ГЕПАТИТА С. Инфицирование ВГС приводит к развитию острого гепатита С (ОГС), протекающего в манифестной (желтушной) или чаще в латентной (безжелтушной) форме, развивающихся в соотношении не менее чем 1 : 6. Около 17-25% больных ОГС выздоравливают спонтанно, у остальных 75-83% развивается хронический гепатит С. Большинство больных с биохимическими признаками хронического гепатита имеют слабовыраженную или умеренную степень некрозо-воспалительного поражения печени и минимально выраженный фиброз. Отдаленный исход у них неизвестен. Примерно у 26-35% больных хроническим гепатитом С в течение 10-40 лет развивается фиброз печени и может наступить смерть от цирроза печени и его осложнений. У 30-40% больных с циррозом печени возможно формирование рака печени. Спектр клинических исходов при гепатите С представлен на схеме № 2. Схема № 2 СПЕКТР КЛИНИЧЕСКИХ ИСХОДОВ ПРИ ГЕПАТИТЕ С
Результатом ГС-инфекции может явиться широкий спектр болезни печени, включая цирроз, рак печени и субклиническое, непрогрессирующее течение хронического гепатита. Сегодня о спонтанном выздоровлении от гепатита С можно говорить в случаях, когда пациент, не получая специфической терапии, хорошо себя чувствует, что сопровождается нормальными биохимическими показателями крови, отсутствием увеличения размеров селезенки и печени и отсутствием в крови РНК ВГС не менее 2 лет после острого гепатита С. Однако окончательные критерии выздоровления пока еще не установлены. 6. ОСТРЫЙ ГЕПАТИТ С. Острый гепатит С – инфекция, вызванная ВГС; в клинически выраженных случаях характеризуется симптомами острого поражения печени, которое чаще всего протекает с умеренной интоксикацией и в большинстве случаев заканчивается развитием хронического гепатита. 6.1. Клиническая диагностика Диагноз ОГС основывается на комплексе клинических (увеличение печени и селезенки), биохимических (повышение уровня активности аминотрансфераз-АСТ, АЛТ), вирусологических (наличие в крови РНК ВГС и/или анти-ВГС) данных, которые имеют четкую связь с парентеральными манипуляциями за 1-4 месяца до его развития: переливанием крови, хирургическими операциями, первой инъекцией наркотических средств и т.п. Антитела к белкам, кодируемым зоной РНК ВГС NS3 и NS5, не являются абсолютными маркерами как острого, так и хронического гепатита С. У большинства пациентов отсутствуют признаки острого гепатита. Обнаружение РНК ВГС на фоне анти-ВГС не позволяет отличить острый гепатит С от обострения хронического гепатита С. Диагностика острого гепатита С в большинстве таких случаев должна базироваться на наличии соответствующих данных эпиданамнеза за 1-4 месяца до впервые выявленных признаков гепатита С – анти-ВГС и ферментемии. После ОГС больной подлежит диспансерному наблюдению в кабинете инфекционных заболеваний территориальной поликлиники. 6.2. Лечение 6.2.1. Интерферонотерапия В настоящее время интерферонотерапия (ИФН-терапия) занимает лидирующее место в лечении как острого, так и хронического гепатита С. В случаях диагностики острого гепатита С можно рекомендовать лечение альфа-интерферонами сразу после установления диагноза в дозе 3 млн МЕ трижды в неделю в течение 6 месяцев. 6.2.1.1. Мониторинг безопасности ИФН-терапии включает: Всем больным во время ИФН-терапии обязательно проводят исследование активности АЛТ и клинический анализ крови 1 раз в 2 недели в первый месяц лечения и ежемесячно в дальнейшем. Кроме того, до начала лечения необходимо исследовать показатели функции щитовидной железы и аутомаркеры: -при нормальных уровнях вышеперечисленных показателей необходимо проводить их тестирование – 1 раз в 6 месяцев; -при измененных уровнях необходим ежемесячный контроль всех показателей. 6.2.1.2. Мониторинг эффективности ИФН-терапии включает: Исследование АЛТ, РНК ВГС сразу после окончания 6 мес. терапии и в дальнейшем 1 раз в полгода в течение 2-х лет (в случаях стойкого положительного эффекта). 7. ХРОНИЧЕСКИЙ ГЕПАТИТ С. Хронический гепатит С (ХГС) – это диффузное заболевание печени продол-жительностью 6 и более месяцев, причиной которого является вирус гепатита С. 7.1. Клиническая диагностика Критериями для постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови сроком не менее 6 месяцев, при исключении других хронических заболеваний печени, согласно международной классификации 1994 года. Точный характер поражения печени, а именно, степень некрозо-воспалительных изменений и стадию фиброза, позволяет определить биопсия печени. Результаты исследования биопсии печени дают точку отсчета у конкретного больного .Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный). 7.2. Лечение Лечение больных с хроническим гепатитом С должно проводиться в центрах, обеспечивающих соблюдение правил санэпидрежима, специалистами-гепатологами (инфекционистами и гастроэнтерологами). При наличии у больных тяжелых сопутствующих заболеваний пациентам должно проводиться лечение ХГС гепатологами совместно со специалистами согласно профилю заболевания пациента (урологом, онкологом, кардиологом, эндокринологом, венерологом и др.). В большинстве случаев лечение ХГС может осуществляться в амбулаторно-поликлинических условиях. 7.2.1. ИФН-терапия ИФН-терапия безусловно показана: -взрослым больным от 18 до 60 лет, -при постоянном повышении уровней АЛТ, -при наличии РНК ВГС в крови, -при наличии в биоптате печени умеренно выраженного воспалительного процесса или фиброза. В случае наличия вышеперечисленных показаний к ИФН-терапии, первостепенной задачей клинициста является оценка возможной эффективности для конкретного пациента. Основанием для назначения монотерапии ИФН может служить наличие следующих факторов, указывающих с большой долей вероятности на конечный благоприятный лечебный эффект: молодой возраст на момент заражения (до 40 лет), женский пол, отсутствие избыточного веса, повышенного уровня железа и гамма-ГТП в сыворотке крови, повышенные уровни АЛТ, наличие умеренной степени активности процесса и минимального фиброза по данным биопсии печени, невысокий уровень РНК ВГС и «не 1» генотип ВГС. Отсутствие этих факторов может рассматриваться как показание к назначению комбинированной терапии. Стандартной монотерапией альфа-ИФН является введение 3 млн. МЕ препарата трижды в неделю в течение 12 месяцев, при условии исчезновения РНК ВГС через 3 мес. от начала лечения. В случаях обнаружения РНК ВГС после 3 мес. лечения продолжать терапию по указанной схеме нецелесообразно. При отсутствии показаний к ИФН-терапии необходимо проведение динамического наблюдения и базисного, в основном симптоматического, лечения (особенно при сопутствующих заболеваниях). Контрольные исследования биохимических показателей крови целесообразно исследовать 1 раз в 3 мес.: РНК ВГС, белковый спектр крови, протромбин и альбумин – 1 раз в 6 мес.; УЗИ и альфа-фетопротеин – 1 раз в 12 мес. В случаях проведения только базисной терапии при динамическом обследовании рекомендуется провести повторную биопсию печени через 4-5 лет. Противопоказания к назначению ИФН-терапии представлены в инструкции по применению коммерческих препаратов ИФН. 7.2.1.1. Оценка (мониторинг) эффективности ИФН-терапии при ХГС. Включает в себя следующие показатели: уровень АСТ или АЛТ, наличие или отсутствие РНК ВГС, временной фактор. Биохимическая ремиссия в конце лечения – нормализация уровней АСТ и АЛТ сразу после окончания терапии; Полная ремиссия в конце лечения – нормализация уровней АСТ и АЛТ и исчезновение РНК ВГС из крови сразу после окончания терапии; Стабильная биохимическая ремиссия – сохранение нормального уровня АСТ и АЛТ через 6 мес. и более после прекращения терапии; Стабильная полная ремиссия – сохранение нормального уровня АСТ и АЛТ, а также отсутствие РНК ВГС через 6 мес. и более после прекращения терапии; В случаях достижения стабильной полной ремиссии через 6 мес. после окончания лечения рекомендуется продолжить наблюдение за больным не менее 2-х лет с периодичностью 1 раз в полгода и последующей биопсией печени. Рецидив болезни – повышение уровня АСТ и АЛТ и / или появление РНК ВГС в крови после прекращения лечения. Отсутствие лечебного эффекта – отсутствие нормализации уровня АСТ или АЛТ и/или сохранение РНК ВГС в крови в течение 3 мес. после начала лечения и/или в конце лечения. Любой достигнутый эффект на монотерапию ИФН должен быть учтен клиницистом, т.к. имеет значение для дальнейшей тактики лечения. Мониторинг безопасности терапии при ХГС проводится аналогично острому ГС. 7.2.2. Комбинированная терапия Рекомендованной к применению комбинированной терапией является сочетание альфа-интерферона с рибавирином для следующих категорий больных ХГС: – пациентов, у которых выявлены неблагоприятные прогностические факторы, указывающие на низкий уровень эффективности монотерапии ИФН и которые не лечились ранее препаратами интерферона; – пациентов, у которых произошел рецидив болезни после прекращения лечения интерферонами. Мониторинг эффективности и безопасности комбинированной терапии аналогичен таковому при проведении монотерапии ИФН и дополнительно включает в себя тестовый контроль на беременность с целью ее исключения в течение всего периода лечения и 4-6 мес. после его окончания. Эффективность комбинированной терапии у больных, которые не отвечали на монотерапию интерфероном, в настоящее время находится в стадии изучения. Пациенты могут участвовать в исследовании различных схем лечения в рамках Протокола клинических испытаний. 7.3. Лечение урсодезоксихолиевой кислотой (УДХК) Использование УДХК в лечении ХГС является вспомогательным средством. Основным показанием для назначения УДХК следует считать наличие холестаза. Сочетание с интерферонами не увеличивает эффективность альфа-интерферонов в отношении элиминации ВГС, но может уменьшить частоту биохимического рецидива заболевания. 7.4. Лечение хронического гепатита С у больных с аутоиммунными нарушениями Терапия противовирусными препаратами в настоящее время находится в стадии накопления клинического опыта. Лечение, особенно препаратами интерферона, следует назначать строго индивидуально, желательно в рамках Протокола клинических испытаний, обеспечивающего безопасность терапии. При выраженной клинической и лабораторной картине аутоиммунного заболевания, особенно аутоиммунного гепатита, предпочтение в начале лечения следует отдать преднизолонотерапии. 7.5. Лечение хронического гепатита С у детей Программа лечения детей с ХГС должна включать в себя только те препараты, безопасность и эффективность которых не вызывает сомнения. Ввиду вялотекущего течения хронического гепатита С и того, что эффективность применения интерферонов у детей находится в стадии изучения, ИФН-терапию детям целесообразно назначать в рамках Протокола клинических испытаний. 7.6. Варианты лечения хронического гепатита С в стадии выраженного фиброза или компенсированного цирроза печени (класс А по Чайльд-Пью) Лечение подобного контингента больных остается проблематичным из-за небольшой эффективности современных терапевтических средств и плохой их переносимости. Предпочтительным является назначение комбинации альфа-интерферона с рибавирином в рамках Протокола клинических испытаний. При отсутствии эффекта или наличии противопоказаний к рибавирину может применяться длительная монотерапия ИФН с целью получения и сохранения биохимического ответа. Такая стратегия может замедлять прогрессирование болезни, угнетая фиброгенез, и снизить риск развития рака печени. Обязательным является мониторинг исследований, включающий помимо ежемесячного контроля биохимических и клинических показателей крови определение концентрации протромбина, ?-фетопротеина и УЗИ каждые 6 месяцев. 7.7. Интерферонотерапия больных хроническим гепатитом С с сопутствующими заболеваниями За последние годы выработаны четкие критерии обоснования назначения интерферонотерапии при хроническом гепатите С. Это в первую очередь профилактика развития цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК), как исходов хронического гепатита. У пациентов без сопутствующей патологии схемы применения ИФН отработаны и подход к лечению унифицирован. Лечение больных с сопутствующей патологией требует особого подхода, т.е. выработки специальной тактики интерферонотерапии. Этот очень важный принцип индивидуализации лечения помогает просчитать соотношение целесообразность/безопасность и избежать необоснованной терапии и ее осложнений у больного с хроническим гепатитом С и сопутствующим заболеванием. В связи с этим важно убедиться в том, что терапия интерфероном действительно обоснована у данного конкретного пациента (наличие репликации ВГС, наличие стойкого или волнообразного повышения активности АЛТ, в сочетании с умеренной или выраженной активностью гепатита по данным морфологического исследования печени). При определении показаний к лечению интерфероном у пациента с гепатитом С и сопутствующими заболеваниями очень важно оценить, какая патология является ведущей. Решающим фактором может служить темп прогрессирования сопутствующего заболевания. При наличии сопутствующего заболевания с быстрой прогрессией от терапии интерфероном гепатита С в большинстве случаев следует воздержаться из-за риска осложнений интерферонотерапии, которые могут в свою очередь увеличить темп прогрессии сопутствующего заболевания. 7.7.1. Терапия интерфероном хронического гепатита С у ВИЧ – инфицированных пациентов Обоснованием назначения интерферона у данной группы пациентов является наличие активного гепатита С (повышение активности трансаминаз, РНК ВГС в сыворотке, морфологические данные, свидетельствующие об активном хроническом гепатите). Лечение интерфероном у этой категории больных можно проводить в рамках клинических испытаний при отсутствии симптомов ВИЧ-инфекции и выраженной иммуносупрессии (содержание CD4+ клеток более 500/мкл). При этом должны использоваться стандартные дозы препаратов. При условии тщательного мониторинга за уровнем CD4+ клеток и РНК ВИЧ возможно проведение комбинированного лечения: ИФН + рибавирин. Перспективными являются исследования по безопасности и эффективности проведения антиретровирусной терапии в сочетании с терапией интерфероном у ВГС-ВИЧ коинфицированных пациентов. Их целью является разработка четких показаний к такой терапии, основанных на комплексе показателей: результатов пункционной биопсии печени, иммунного статуса, стадии ВИЧ-инфекции с учетом уровня вирусной нагрузки и генотипа ВГС. 7.7.2. Лечение хронического гепатита С у больных туберкулезом Эффективность и безопасность лечения интерфероном хронического гепатита С у больных туберкулезом не изучена. Кандидатами на проведение интерферонотерапии по поводу хронического гепатита С в рамках клинических испытаний с использованием стандартных доз ИФН могут являться больные туберкулезом в стадии ремиссии, имеющие клинико-лабораторные и морфологические признаки активно текущего гепатита С. 7.7.3. Лечение хронического гепатита С у больных алкоголизмом и наркоманией Условием назначения интерферонотерапии гепатита С может быть только полный отказ от употребления алкоголя. Терапия интерфероном лиц, продолжающих употреблять наркотики внутривенно, нецелесообразна из-за высокого риска реинфицирования и осложнений интерферонотерапии на фоне наркотизации. Условием назначения интерферона лицам, употреблявшим наркотики, может быть только полный отказ от приёма наркотиков и наличие 2-х месячного периода ремиссии от последнего употребления наркотика, отсутствие психической и физической зависимости, требующей лекарственной терапии, отсутствие депрессии. Лечение указанных категорий пациентов должно проводиться с использованием стандартных доз ИФН. 7.7.4. Лечение хронического гепатита С у пациентов с патологией почек Принципиально отличаются подходы к назначению ИФН-терапии у больных с хронической почечной недостаточностью (ХПН), находящихся на программном гемодиализе, в зависимости от планируемой трансплантации почки. У больных, которым не планируется пересадка почки, лечение ИФН назначается при наличии морфологически выраженных изменений в ткани печени, т.к. активность АЛТ не отражает в большинстве случаев активность ХГС. Пункционная биопсия печени у них проводится с учетом общепринятых противопоказаний. Пациентам с ХГС, которые находятся в ходе подготовки к пересадке почки, можно назначать ИФН без учета данных морфологического исследования печени, в стандартной дозе, после каждого сеанса гемодиализа, в рамках Протокола клинических испытаний. Применение рибавирина у этой категории больных противопоказано в связи с риском накопления метаболитов рибавирина в эритроцитах. Больным, подвергшимся аллотрансплантации почек, назначать ИФН для лечения хронического гепатита С не рекомендуется, т.к. это может повысить риск отторжения трансплантата. У этой категории больных перспективным представляется изучение эффективности монотерапии рибавирином. 7.7.5. Лечение интерфероном хронического гепатита С у больных сахарным диабетом Эффективность и безопасность применения препаратов ИФН для лечения гепатита С у больных сахарным диабетом, получающих инсулин, не изучена. У больных диабетом лечение интерфероном следует проводить с использованием стандартных доз в рамках клинических исследований. Противопоказанием к лечению интерфероном является декомпенсированный сахарный диабет. 7.7.6. Лечение интерфероном больных хроническим гепатитом С и гемофилией Больным с тяжелой формой гемофилии проведение интерферонотерапии не рекомендуется (в связи с высоким риском образования гематом в местах инъекций). При гемофилии легкой и средней тяжести и наличии клинико-лабораторных показателей активности гепатита С в рамках клинических исследований возможно проведение ИФН-терапии с использованием стандартных доз препарата. Перспективным является изучение эффективности комбинации ИФН + рибавирин. Пункционная биопсия печени пациентам с гемофилией не проводится. 7.7.7. Лечение интерфероном больных хроническим гепатитом С с онкологическими заболеваниями Лечение хронического гепатита С у пациентов с онкологическими заболеваниями может проводиться с использованием стандартных доз ИФН в рамках клинических исследований при соблюдении следующих условий: клинико-лабораторные и морфологические показатели активности гепатита С, ремиссия по основному заболеванию, отсутствие лучевой терапии или химиотерапии. 7.8. Беременность и гепатит СВопросы перинатальной (вертикальной) передачи ВГС-вирусной инфекции (от матери к плоду во время беременности) остаются пока не до конца изученными. Заражение ребенка возможно, если у матери имеется во время беременности и родов активная вирусная репликация. При этом в крови женщины обязательно обнаруживают РНК ВГС. Но даже в этих случаях вертикальный механизм передачи реализуется лишь в 4-10% случаях, т.е. большинство новорожденных не инфицируется во время беременности и родов. Горизонтальная передача ГC-вируса возможна при тесных контактах матери и ребенка, особенно в первые месяцы жизни, и связана с микротравматизацией слизистых и кожных покровов. При отсутствии повреждения молочной железы (трещин) у родильниц ребенок может находиться на грудном вскармливании. Выявление анти-ВГС у беременной женщины не является показанием к искусственному прерыванию беременности или родоразрешению с помощью кесарева сечения. Лечение гепатита С во время беременности этиотропными препаратами не проводится. При сроках обследования детей, родившихся от матерей с анти-ВГС, необходимо учитывать, что материнские анти-ВГС могут циркулировать в крови ребенка до 1,5 лет. Вследствие этого, не рекомендуется проводить раннее (до 1 года жизни) или частое обследование детей на анти-ВГС, т.е. выявление их до 1-1,5 лет может способствовать ложной диагностике гепатита С у ребенка. У большинства детей, рожденных от матерей с анти-ВГС, к 1,5 годам анти-ВГС исчезают. Спектр «открытых вопросов», требующих изучения. Главным, всё ещё не решенным, остаётся вопрос о создании вакцины против гепатита С и следующие вопросы: I. Клиника 1. Что является критерием полного выздоровления при остром гепатите С? 2. Какие факторы способствуют прогрессирующему и непрогрессирующему естественному течению процесса при ВГС-инфекции? 3. Возможно ли полное выздоровление после проведенной специфической терапии? 4. Каковы морфологические изменения у лиц со стабильной клинико-биохимической и вирусологической ремиссией – спонтанной и после лечения? II. Диагностика 5. Каково значение антител к белкам, кодируемым различными зонами РНК ВГС при различных формах ВГС-инфекции? 6. Имеются ли и каковы они – новые диагностические признаки ОГС и ХГС в отсутствие желтухи ? III. Эпидемиология 7. Причины территориальной неравномерности распространения гепатита С ? 8. Какова активность естественных путей передачи ВГС ? IV. Служба Крови 9. Каков остаточный риск инфицирования реципиентов компонентами крови доноров? V. Лечение 10. Несмотря на то, что индукторы интерферона и непарентеральная форма интерферона рекомендованы МЗ РФ к применению у больных ОГС и ХГС, участники конференции считают необходимым продолжение изучения эффективности этих препаратов в контролированных исследованиях. 11. Необходимо усовершенствовать и внедрить «унифицированные» карты мониторинга исследования» больных острым и хроническим гепатитом С, получающих лечение противовирусными препаратами.
Информация с сайта – http://www.hepatit.ru/GC-RK.htm Вертикальная передача вируса гепатита СLatifa T. F. Yeung, Susan M. King, and Eve A. Roberts Вирусный гепатит С (HCV) передается при переливании инфицированной крови и ее производных или посредством других механизмов, не имеющих отношения к гемотрансфузиям, что позволяет классифицировать инфекцию как социально-приобретаемое заболевание. В развитых странах доминатный механизм распространения HCV-инфекции постоянно меняется. В детском возрасте гепатит С имеет в основном трансфузионное происхождение. После того, как продукты крови стали с 1991 года проходить скрининговое обследование на HCV, частота пост-трансфузионных заболеваний гепатитом С заметно снизилась. Но, так как число детей с пост-трансфузионным гепатитом растет, распространение социально-приобретенного детского гепатита С будет увеличиватьтся [1]. Частота передачи HCV от матери ребенку играет решающую роль в прогнозировании распространенности HCV инфекции в следующих генерациях. Передача вируса от матери ребенку может происходить внутриутробно, во время родов или в постнатальный период. Факторы, которые оказывают влияние на то, будет или нет инфицирован ребенок, нуждаются в дальнейшем уточнении. Если ими можно управлять, это представляет собой направление деятельности с целью минимизировать вероятность вертикальной передачи вируса. В обзоре суммированы данные о частоте вертикальной трансмиссии HCV от матери ребенку, имеющиеся в мировой литературе. Модернизированные ПЦР-методики определения РНК HCV, а также более масштабные исследования в дальнейшем позволят уточнить оценку этого пути заражения гепатитом С. Обзор опубликованных данных о вертикальной трансмиссии HCV проводился с января 1990 по декабрь 2000 года. Статьи выбирались по ключевым словам (гепатит С, передача заболевания от матери ребенку, взаимоотношения матери и плода, плацента, мать-ребенок, мать-новорожденный, новорожденный, беременные, беременность) в базах MEDLINE и EMBASE. Библиография рассматриваемых статей анализировалась с целью выявления дополнительных ссылок. Ограничений по языку не устанавливалось. В данном обзоре трансмиссия HCV от матери ребенку определялась как персистенция в сыворотке анти-HCV антител у ребенка по истечении по меньшей мере 12 месяцев или выявление сывороточной РНК HCV по крайней мере однократно. Результаты определения РНК HCV в пуповинной крови не принимались во внимание в связи с возможность контаминации материала материнской кровью. В обзор включались только оригинальные статьи, в которых упоминалось не менее 10 случаев анти-HCV-позитивности женщин-матерей. Исследования, в которых использовались методики ELISA первого поколения или рекомбинантный иммуноблот (RIBA) без подтверждающего ПЦР тестирования, не анализировались. Спонтанный клиренс вертикальной HCV-инфекции (иногда интерпретируемый как транзиторная виремия) был определен как серореверсия сывороточной HCV РНК (выявленной по меньшей мере однократно) и последующая HCV РНК-негативность, что может сопровождаться повышением аминотрансфераз в период HCV РНК-позитивности и последующим исчезновением сывороточных анти-HCV. Частота вертикальной трансмиссии вируса выражалась в виде расчетного и взвешенного уровней [расчетный уровень = (а1+а2+…+ах)/( n1+n2+…+nх); взвешенный уровень= (р1 w1+р2 w2+…+рх wх)/( w1+w2+…+wх), где i=1-х общей частоты, аi = числитель каждого отдельного уровня, ni = знаменатель каждого уровня, рi = индивидуальная частота, qi =1– pi , wi =1/отклонение = ni / pi qi]. Расчетный уровень вычислялся просто как сумма описанных случаев инфицирования новорожденных, деленная на общее количество пар мать-дитя. Преимущество взвешенного уровня состоит в том, что данные каждого исследования учитывались с поправкой, выраженной в величине, обратной отклонению. Таким образом, размер выборки и отклонение каждого исследования нашли отражение во взвешенном уровне. Частота, полученная в исследованиях большого количества пар мать-ребенок, внесет больший вклад по сравнению с менее масштабными исследованиями. В обзор вошли данные 77 исследований, опубликованные в период с 1992 по 2000 год. Число анти-HCV –позитивных пар мать-ребенок варьировало от 10 до 1,338 на исследование. В статьях, вошедших в этот обзор, зарегистрировано в целом 363 случая вертикальной трансмиссии HCV. Большинство исследований было проведено в Италии и Японии (Таблица 1). Одна ирландская серия исследований была посвящена обследованию женщин, получивших HCV-контаминированный анти-D иммуноглобулин. В нескольких исследованиях, не вошедших в этот обзор по причине небольшого числа обследованных пациентов, изучалась в большей степени роль HCV нуклеотидных последовательностей и квазивидов в отдельных случаях вертикальной передачи вируса от матери ребенку, нежели реальный уровень трансмиссии [2-15]. Определив нуклеотидные последовательности HCV-РНК клонов, выделенных от женщин и детей, можно вычислить степень их генетической разнородности. Часто проводится сравнение наиболее быстро эволюционирующего региона HCV генома, гипервариабельного региона, используя филогенетический анализ, для того, чтобы продемонстрировать трансмиссию материнского HCV ребенку. Степень гомологии двух образцов HCV РНК может быть измерена уровнем нуклеотидных замен (d ), нуклеотидных различий (p , среднее число нуклеотидных отличий [6]), или генетической отдаленностью образцов (Ка/Кs, соотношение антонимных и синонимных замен, которое служит индексом позитивного селективного отбора на молекулярном уровне [3, 13]. Эти исследования показали, что дети имеют единственный доминантный вариант, в то время как у матерей можно обнаружить множественные варианты [9]. Несмотря на то, что штаммы HCV у новорожденных могут быть представлены минорными материнскими штаммами [5], степень их генетического расхождения начинает увеличиваться с 6-7 месячного возраста [13]. Эволюция HCV штаммов у новорожденных отличается от наблюдаемой у их матерей и число замен нуклеотидов растет по мере увеличения возраста [6, 10]. Определение РНК HCV у новорожденных в первые 24 часа жизни означает внутриутробное заражение, так как у шимпанзе РНК HCV удается обнаружить только на 3-4 день после инокуляции. В то время, как анализ гипервариабельного региона дает представление о наиболее поздних изменениях, анализ более консервативной области, NS5B, позволяет судить о событиях более отдаленных. Последовательность нуклеотидов NS5B может быть определена путем прямого секвенирования без трудоемкого клонирования, что представляет собой реальную альтернативу для диагностики вертикальной трансмиссии [11]. Качество исследований в значительной степени зависит от количества обследованных пар мать-ребенок (размер выборки), определения пути заражения (мать-ребенок), частоты и длительности наблюдения за ребенком и методов вирусологического обследования. Все исследования были основаны на когортном анализе ( уровень ”C” по Guyatt et al.[16]). Распространенность гепатита С среди беременных женщинПроцент HCV-позитивных беременных среди всех беременных женщин, согласно различным исследованиям, варьирует чрезвычайно широко (0.6%-95.4%, среднее = 10.3% SD=21/9%) К примеру, три исследования с максимальной превалентностью (70.1%-95.4%) были проведены в группах внутривенных наркоманов [17, 19]. Среди анти-HCV-позитивных женщин у 26.8-94.4% определялась РНК HCV (в среднем 65.5%, SD=14.6%). В исследованиях, включенных в этот обзор, вертикальная трансмиссия HCV от матери ребенку определялась при условии персистенции анти-HCV у новорожденного по истечении 12-месячного возраста или выявлении РНК HCV, по крайней мере, однократно, до 18 месяцев. В большинстве исследований проводился по крайней мере один анализ на РНК HCV. В некоторых исследованиях проводилась более тщательная диагностика вертикальной трансмиссии, например, определение анти-HCV у новорожденного по достижении 18-месячного возраста, детекция РНК HCV через 6 месяцев жизни, определение РНК HCV по крайней мере дважды, повышенный уровень аминотрансфераз или перекрестный генотип материнских и детских штаммов. Частота вертикальной трансмиссии вируса от матери ребенкуЧастота вертикальной трансмиссии, указываемая в литературных источниках, варьирует от 0% до 35.3% среди детей, рожденных анти-HCV позитивными женщинами. Расчетный уровень среди анти-HCV-позитивных женщин составлял 5.6% (SD=0.3%). Когда он был определен с поправкой на дисперсию для каждой отдельно определенной частоты, взвешенный уровень составил 1.7%. Среди исследований в единственном упоминается случай, когда имела место вертикальная трансмиссия вируса от РНК HCV-негативной женщины [20]. Если ограничить выборку только женщинами с виремией, частота вертикальной трансмиссии будет колебаться в пределах от 0 до 100%, отражая гетерогенность исследуемой популяции. Взвешенный уровень вертикальной трансмиссии вируса среди РНК HCV-позитивных женщин составлял 4.3% (расчетный уровень = 8.1%, SD=0.5%). Варианты HCV-трансмиссии могут отличаться в различных группах [21]. Взвешенный уровень для анти-HCV-позитивных женщин в исследованиях, проведенных в Италии, Японии и других странах, составил 5.0%, 3.6% и 1.0%, соответственно. Взвешенный уровень вертикальной трансмиссии среди виремических женщин в Италии, Японии и в других исследованиях был 5.6%, 6.9% и 3.1%, соответственно. Структура исследований, проводимых в Италии, Японии и других странах, была сопоставима. Подходы к диагностике трансмиссии вируса от матери ребенку отличались в разных исследованиях. Когда все исследования были сгруппированы по степени строгости определения вертикальной передачи вируса (2 или более положительных результата РНК, один или более положительный результат РНК, отсутствие РНК-тестирования), взвешенный уровень частоты вертикальной трансмиссии среди анти-HCV позитивных женщин составил 7.1% в исследованиях, предусматривающих 2 или более положительных РНК-тестов, 3.9% в исследованиях с 1 или более положительным РНК-результатом и 0.6% в случаях, когда не проводился РНК-анализ. Коинфекция вирусом иммунодефицита человекаЧастота вертикальной трансмиссии вируса гепатита С повышается среди женщин, коинфицированных вирусом иммунодефицита (ВИЧ), по сравнению с женщинами без ВИЧ-инфекции. На основании 8 исследований, в которые вошли данные по ВИЧ-позитивным и ВИЧ-негативным женщинам, расчетный уровень вертикальной трансмиссии составил 22.1% (SD=2.1%) и 4.3% (SD=0.8%), соответственно. Взвешенный уровень трансмиссии вируса от матери ребенку составлял 19.4% и 3.5%, соответственно. Внутривенное использование наркотиковСреди пациентов, внутривенно применяющих наркотики (ВВПН), распространенность хронического гепатита С очень высока [29]. Анализ вертикальной трансмиссии HCV от матери ребенку среди ВВПН и не употребляющих наркотики показал, что ВВПН сопровождается повышенной вероятностью трансмиссии. В 6 исследованиях, в которые были включены данные по женщинам с ВВПН и без него, расчетный уровень вертикальной трансмиссии среди детей, рожденных анти-HCV-позитивными женщинами с ВВПН был 10.8% (SD=1.9%). Взвешенный уровень составил 8.6%. Соответствующие расчетный и взвешенный уровни для женщин, не использующих наркотики, составили 4.2% (SD=1.1%) и 3.4%, соответственно [20, 25, 27, 30-32]. Материнские вирусные титрыСуществует тесная корреляция между повышенными титрами РНК HCV у матери и вероятностью вертикальной трансмиссии вируса от матери ребенку. Несмотря на то, что вертикальная передача может иметь место при широком разбросе титров у женщин-матерей, в 9 исследованиях статистически достоверно повышенные вирусные титры сопровождались повышенной вероятностью вертикальной передачи инфекции [19, 33, 34, 40, 42-46]; а в 9 исследованиях такой закономерности не наблюдалось [18, 20, 27, 35-39, 41]. Большинство исследователей отмечали вертикальную передачу вируса гепатита С, когда вирусные титры превышали уровень в 105-106 копий/мл. В одном исследовании более высокие титры материнской сывороточной HCV РНК также коррелировали с более высокими титрами HCV РНК в молозиве [47]. Время проведения анализа сыворотки с целью определения материнских вирусных титров указывается с различной степенью точности. Несмотря на то, что в большинстве исследований описано взятие материала во время родов, сроки колеблются от третьего триместра беременности до периода после родов. В 5 исследованиях, включая несколько, где титр материнских HCV РНК не повлиял на частоту трансмиссии вируса, время взятия сыворотки не было указано [18, 33, 41-43, 45]. Способ родоразрешенияСпособ родоразрешения был определен как фактор риска вертикальной трансмиссии вируса от матери ребенку в 11 исследованиях [24-26, 34-38, 44, 48, 49]. Среди новорожденных, рожденных естественным путем и путем кесарева сечения, общая частота вертикальной передачи вируса была сходной. При естественных родах и кесаревом сечении, соответственно, взвешенный уровень трансмиссии вируса от матери ребенку составил 4.3% и 3.0% (растчетный уровень 6.7%, SD=0.7% и 6.8%, SD=1.2%, соответственно). В одном исследовании было высказано предположение о повышении вероятности вертикальной трансмиссии в связи с более длительным периодом нарушения целостности оболочек. Грудное вскармливаниеРоль грудного вскармливания как фактора риска вертикальной передачи HCV оценивалась в 10 исследованиях [24-27, 31, 34, 35, 38, 40, 48]. Только в одном из них были указаны его размеры (длительность и исключительность) [24]. Общий уровень вертикальной трансмиссии вируса у кормящих грудным молоком и некормящих женщин не отличался. Взвешенный уровень вертикальной трансмиссии составил 3.7% и 3.9% среди детей на грудном и искусственном вскармливании, соответственно (расчетный уровень 6.0%, SD=1.1% и 6.3%, SD=0.8% для детей на грудном и искусственном вскармливании, соответственно). Несмотря на то, что некоторые исследователи определяли РНК HCV в грудном молоке, случаев передачи HCV через молоко не было зарегистрировано. ГенотипОпределение вирусного генотипа проводилось редко, в 32 из анализируемых исследований [17, 19, 20, 23, 25, 27, 28, 33-35, 37, 38, 40, 41, 45, 46, 50-65]. В большинстве случаев указывались генотипы вирусов, выделенных у инфицированных новорожденных. Поэтому заключений о влиянии генотипа на частоту вертикальной трансмиссии сделано не было. Последствия инфицирования ребенкаДанные о клинических исходах инфицирования у новорожденных носят исключительно спорадический характер. В большинстве анализируемых серий не описано ни одного симптома заболевания печени, что, скорее всего, связано с тем, что внимание исследователей акцентировалось на определении частоты вертикального переноса вируса, нежели долговременных наблюдениях клинических исходов. Однако в одном из исследований, проведенном в Египте, из 20 РНК HCV-позитивных новорожденных 4 погибли в результате тяжелого воспалительного заболевания печени в шестимесячном возрасте. 16 детей остались хронически больны. Только 9 из них впоследствии стали асимптоматическими носителями, оставаясь хронически инфицированными [55]. Возникает естественный вопрос, почему египетские дети более других, рожденных HCV-инфицированными женщинами, пострадали от инфекции? В статьях, анализирующих уровень вертикальной передачи инфекции от матери ребенку, результаты гистологического исследования печени приводятся только у 17 новорожденных. Возраст, в котором у детей проводилась биопсия, варьирует от 9 месяцев до 5.5 лет [23, 46, 66]. В большинстве случаев биопсия печени выявила изменения, характерные для хронического гепатита. Фиброз при биопсии был описан в 3 случаях [67]. Один ребенок прошел успешное лечение интерфероном-a [25]. Трое из 17 детей погибли [36], один из них был коинфицирован ВИЧ [27], а другие в течение 6 месяцев получали парентеральное питание [26]. О спонтанном исчезновении сывороточной РНК HCV, интерпретируемом как клиренс HCV инфекции или транзиторная виремия, сообщалось в 59 случаях [17, 18, 25, 28, 34, 38, 41-43, 52, 57, 66, 68-73]. У этих детей РНК HCV в сыворотке была обнаружена по крайней мере однократно, впоследствии, однако, эти дети были признаны РНК HCV-негативными. У многих из них затем исчезли сывороточные анти-HCV. Шестеро из таких новорожденных имели повышенныей уровень аминотрансфераз в период сывороточной HCV РНК-позитивности [19, 28, 63, 65]. Пассивным переносом материнских антител сопровождалось большинство случаев рождения детей женщинами, инфицированными HCV. Постепенное снижение содержания сывороточных анти-HCV у новорожденных происходило в течение первых 18 месяцев жизни в большинстве случаев. Из 45 исследований, в которых приводились данные о клиренсе анти-HCV, только в трех упоминались случаи, когда исчезновение материнских антител произошло между 20-24 месяцами жизни [32, 35, 74]. Принимая во внимание данные всех вошедших в этот обзор исследований, уровень вертикальной трансмиссии HCV от матери ребенку у анти-HCV –положительных женщин составил от 1.0% до 5.0%. Более высокая частота (3.1%-6.9%) может быть получена, если знаменатель ограничить только женщинами с HCV РНК-виремией. Большинство данных получено на основании японских и итальянских исследований. Частота трансмиссии вируса от матери ребенку может отличаться в различных частях света, так как, например, в Японии и Италии уровни вертикальной передачи инфекции гораздо превышают оценки других исследований. Несмотря на то, что объединенные данные из других стран дают более низкие оценки вертикальной трансмиссии HCV, необычно тяжелые клинические последствия вертикальной инфекции у новорожденных детей в Египте подчеркивают гетерогенность НCV-заболевания. Было выделено несколько факторов, влияющих на вертикальную трансмиссию HCV, в том числе коинфекция ВИЧ, ВВПН, материнские вирусные титры, способ родоразрешения, грудное вскармливание и характеристики вируса (например, генотип). Согласно выводам, сделанным в данном обзоре, женщины с ВИЧ-коинфекцией или с ВВПН в анамнезе чаще других становились источником вертикальной инфекции у детей. Напротив, способ родоразрешения и грудное вскармливание не оказывают заметного влияния на уровень трансмиссии вируса от матери ребенку. Предполагаемые факторы, связанные с характеристиками самого вируса, такие как генотип и вирусный титр, не анализировались в большинстве исследований; их роль как факторов риска вертикальной трансмиссии еще нуждается в окончательном выяснении. Очень важно четко установить вертикальный перенос HCV от матери ребенку. В этом отношении условие определения анти-HCV у детей по истечении 12-месячного возраста или присутствие сывороточной HCV РНК по крайней мере при однократном исследовании, является вполне обоснованным. Когда устанавливаются более жесткие критерии (определение РНК HCV более чем однократное), например, исследования в которых требовалось по крайней мере 2 положительных HCV РНК-результата, оценка частоты вертикальной трансмиссии была гораздо выше, чем в исследованиях, опирающихся на меньшее количество РНК-исследований. Подобные результаты противоречат ожиданиям, что более жесткий подход к определению вертикальной трансмиссии приведет к снижению оценки частоты вертикальной трансмиссии вируса. Однако, единственно способом определения вертикальной трансмиссии невозможно объяснить такое разнообразие оценок уровней трансмиссии. Исследования с более строгим подходом к определению вертикальной передачи инфекции могут также содержать более полные сведения о последующем наблюдении за новорожденными, в них чаще проводится тестирование образцов крови и используются более точные лабораторные методы. Более масштабные исследования дают более точную оценку уровня трансмиссии HCV от матери ребенку по сравнению с теми, где количество обследованных пар не велико. Чтобы разрешить проблему разномасштабных выборок и дисперсий был рассчитан взвешенный уровень трансмиссии. В небольших исследованиях (менее 100 пар мать-ребенок) уровень трансмиссии составлял 9.9% (SD=0.6%), в то время как взвешенный уровень 4.6% (SD=0.4%) оставался в пределах от 1% до 5%. Подобная корректировка помогает понять, почему в более поздних и масштабных исследованиях приводятся более низкие уровни трансмиссии, чем в более ранних исследованиях небольшого размера. Также может быть задан и знаменатель уровня трансмиссии. В большинстве исследований в качестве знаменателя используется число “анти-HCV позитивных женщин”. Однако, большинство случаев вертикальной передачи вируса происходит от женщин с виремией. Если знаменатель ограничить только HCV РНК-позитивными женщинами, уровень вертикальной трансмиссии HCV возрастает. Различия в оценках уровня вертикальной трансмиссии вируса, данных разными исследованиями, могут быть вызваны вариациями в размерах анализируемых выборок, времени тестирования, техник измерения и определении факторов риска. Каждый из этих аспектов требует специального рассмотрения, когда интерпретируются данные о трансмиссии вируса от матери ребенку или планируется очередное проспективное исследование. Длительность наблюдения, время проведения тестирования и его частота также могут повлиять на результат исследования. Указанные сроки наблюдения варьировали от 0 до 23 лет, кроме того, в различных исследованиях количество определений HCV-РНК отличалось. Такие пары мать-дитя, как, например в случаях ВВПН женщиной, реже вовлекались в исследования и гораздо сложнее было проводить длительное наблюдение за рожденными детьми. Уменьшающееся количество детей, тестируемых каждый раз, в масштабном итальянском исследовании [38] позволяет сделать вывод, что происходит неизбежный отбор. Проводимые не систематически анализы крови не позволяют точно определить возраст, в котором произошла серореверсия; более частое тестирование сталкивается с трудностями этического характера, что особенно характерно для педиатрических исследований. Большинство виремических случаев было выявлено рано (до 3-месячного возраста), что говорит в пользу неонатальной или внутриутробной инфекции. Значение возможности проведения анализа в как можно более ранние сроки остается не до конца обоснованным. Одно из последних исследований содержит информацию о том, что сывороточная РНК HCV, присутствующая в образце на 2-м дне жизни, может исчезать к 6 месяцам. Хотя различия в спонтанном клиренсе или транзиторной виремии у новорожденных могут быть клинически не выражены, подобное исчезновение сывороточной РНК может привести к недооценке, если тестирование провести в более позднем возрасте. Определенные различия в результатах тестов могут быть связаны с особенностями измерительных техник. Для того, чтобы избежать проблем с большим количеством ложно-позитивных и ложно-негативных результатов более ранних исследований, использование для определения анти-HCV первого поколения ELISA было критерием исключения данного исследования из обзора. Несмотря на то, что второе и третье поколение ELISA-тестов (с подтверждающим RIBA тестированием) и обратно-транскриптазной ПЦР считаются гораздо более достоверными, ложно-позитивные и ложно-негативные результаты все еще остаются возможными. Методы определения вирусных титров могут иметь различные нижние пределы чувствительности. Кроме того, наличие предполагаемых факторов риска вертикальной трансмиссии нуждается в уточнении. Некоторые пациентки могут умолчать о ВВПН. С другой стороны, врач может отнестись недостаточно внимательно, как этого требуют случаи ВВПН. На вероятность трансмиссии вируса скорее оказывает влияние не способ родоразрешения, а размеры кровообмена матери и плода во время родов [37]. Сходным образом, достаточно неопределенной остается оценка грудного вскармливания: от кормления исключительно грудным молоком до “ни разу не прикладывался к груди”. Хотя титр вируса в организме женщины может служить как информативный фактор риска, время его определения у каждой женщины по отношению к срокам родов должно быть строго заданным. Для того, чтобы титр материнского вируса можно было использовать в качестве прогностического фактора вертикальной трансмиссии HCV, время проведения этого анализа должно быть четко стандартизовано. Наконец, при диагностике HCV-инфекции в детском возрасте следует учитывать следующие моменты: анти-HCV могут иметь материнское происхождение, результат HCV РНК может периодически быть то положительным, то отрицательным (и зависеть от нижнего порога чувствительности метода измерения), уровень аминотрансфераз может быть повышен и нет. Какой-либо достоверной взаимосвязи между положительной HCV серологией и тяжестью печеночной патологии установлено не было. Кроме того, клинические последствия хронического гепатита С у новорожденных носят умеренный характер. Большинство таких детей являются асимптоматическими носителями. Однако, в нескольких случаях при проведении биопсии печени были обнаружены свидетельства хронического гепатита [23,25-27,36,46,66,67]. Прогрессирование заболевания у таких детей – предмет дальнейшего наблюдения. Фиброз был отмечен даже у асимптоматических новорожденных. Феномен спонтанного клиренса или транзиторной виремии был описан у 17% (59 из 351) из всех описанных случаев вертикальной трансмиссии. Это соответствует 17% уровню спонтанного клиренса у 104 детей с вертикально приобретенным гепатитом С [75] и сравнимо с 30% уровнем спонтанного клиренса в педиатрической выборке трансфузионного гепатита С [76, 77]. Напротив, из 320 взрослых с хронической HCV инфекцией только у 2% в период наблюдения в течении по крайней мере 3-х лет произошло снижение и потеря HCV РНК [78]. У детей спонтанный клиренс HCV РНК происходит чаще, чем у взрослых. Дальнейшее изучение факторов, влияющих на персистенцию хронического гепатита С, приобретенного в результате вертикальной трансмиссии вируса, возможно прольет свет на иммунологические механизмы, участвующие в избавлении от HCV инфекции. Общий взвешенный уровень трансмиссии HCV от матери ребенку укладывается в пределы от 1.0% до 5.0%. На основании данных 77 популяционных исследований среди материнских факторов, увеличивающих вероятность вертикальной трансмиссии вируса, были выделены: коинфекция ВИЧ, ВВПН в анамнезе, виремия более 106 копий/мл. Напротив, способ родоразрешения и грудное вскармливание не оказывают заметного влияния на уровень вертикальной трансмиссии вируса. По оценкам, 170 миллионов людей по всему миру хронически инфицированны HCV. Если 35% из них – женщины детородного возраста, с ежегодным уровнем фертильности в 2%, то по самым умеренным оценкам от 10,000 до 60,000 новорожденных будут инфицированы HCV ежегодно. Цитированная литература1. Bortolotti F, Resti M, Giacchino R, Crivellaro C, Zancan L, Azzari C, Gussetti N, et al. Changing epidemiologic pattern of chronic hepatitis C virus infection in Italian children. J Pediatr 1998;133:378-381. 2. Murakami J, Okamoto M, Miyat H, Nagata I, Shiraki K, Hino S. Evolution in the hypervariability region of hepatitis C virus in infants after vertical transmission. Ped Res 2000;48:450-456. 3. Argentini C, Dettori S, Loiacono L, Guadagnino V, Stroffolini T, Rapicetta M. Molecular characterization of HCV 1b intrafamiliar infection through three generations. Virus Genes 1999;18:169-174. 4. Halfon P, Quentin Y, Roquelaure B, Sarles J, Halimi G, Gerolami V, et al. Mother-to-infant transmission of hepatitis C virus: molecular evidence of superinfection by homologous virus in children. J Hepatol 1999;30: 970-978. 5. Kudo T, Yanase Y, Ohshiro M, Yamamoto M, Morita M, Shibata M, Morishima T. Analysis of mother-to-infant transmission of hepatitis C virus: quasispecies nature and buoyant densities of maternal virus populations. J Med Virol 1997;51:225-230. 6. Ni YH, Chang MH, Chen PJ, Lin HH, Hsu HY. Evolution of hepatitis C virus quasispecies in mothers and infants infected through mother-to-infant transmission. J Hepatol 1997;26:967-974. 7. Okamoto M, Nagata I, Murakami J, Hino S, Shiraki K. Shift in the buoyant density of hepatitis C virus particles in infants infected by mother-to-infant transmission. Pediatr Int 1999;41:369-373. 8. Rapicetta M, Argentini C, Spada E, Dettori S, Riccardi MP, Toti M. Molecular evolution of HCV genotype 2c persistent infection following mother-to-infant transmission. Arch Virol 2000;145:965-977. 9. Weiner AJ, Thaler MM, Crawford K, Ching K, Kansopon J, Chien DY, Hall JE, et al. A unique, predominant hepatitis C virus variant found in an infant born to a mother with multiple variants. J Virol 1993;67:4365-4368. 10. Katayama Y, Tajiri H, Tada K, Okada S, Tong WY, Ishido S, Hotta H. Follow-up study of hypervariable region sequences of the hepatitis C virus (HCV) genome in an infant with delayed anti-HCV antibody responses. Microbiol Immunol 1998;42:75-79. 11. Etani Y, Tajiri H, Tada K, Sawada A, Kozaiwa K, Okada S, Hotta H. Molecular diagnosis and liver histology of children with mother-to-child-transmitted hepatitis C virus infection. J Pediatr 1998;133:588. 12. Li R, Sugiyama K, Goto K, Miyake Y, Wada Y. Homology of E2 gene in 8 child-mother pairs infected with hepatitis C virus. Tohoku J Exp Med 1997;183:197-210. 13. Manzin A, Solforosi L, Debiaggi M, Zara F, Tanzi E, Romano L, Zanetti AR, et al. Dominant role of host selective pressure in driving hepatitis C virus evolution in perinatal infection. J Virol 2000;74:4327-4334. 14. Maekawa S, Enomoto N, Kurosaki M, Marumo F, Sato C. Host dependent variation of hepatitis C virus: phylogenetic analyses. Arch Virol 1995;140:2123-2133. 15. Tahara T, Toyoda S, Mukaide M, Hikiji K, Ohba K, Mizokami M. Vertical transmission of hepatitis C through three generations. Lancet 1996;347:409. 16. Guyatt G, Sackett D, Sinclair J, Cook RHD, Cook R. Users’ guides to the medical literature: IX. A method for grading health care recommendations. JAMA 1995;274:1800-1804. 17. Lam J, McOmish F, Burns S, Yap P, Mok J, Simmonds P. Infrequent vertical transmission of hepatitis C virus. J Inf Dis 1993;167:572-576. 18. Garland SM, Tabrizi S, Robinson P, Hughes C, Markman L, Devenish W, Kliman L. Hepatitis C—role of perinatal transmission. Aust N Z J Obstet Gynaecol 1998;38:424-427. 19. Spencer JD, Latt N, Beeby PJ, Collins E, Saunders JB, McCaughan GW, Cossart YE. Transmission of hepatitis C virus to infants of human immunodeficiency virus-negative intravenous drug-using mothers: rate of infection and assessment of risk factors for transmission. J Viral Hepat 1997;4:395-409. 20. Granovsky MO, Minkoff HL, Tess BH, Waters D, Hatzakis A, Devoid DE, Landesman SH, et al. Hepatitis C virus infection in the mothers and infants cohort study. Pediatrics 1998;102:355-359. 21. Ackerman Z, Ackerman E, Paltiel O. Intrafamilial transmission of hepatitis C virus: a systematic review. J Viral Hepat 2000;7:93-103. 22. Maccabruni A, Bossi G, Caselli D, Cividini A, Silini E, Mondelli MU. High efficiency of vertical transmission of hepatitis C virus among babies born to human immunodeficiency virus-negative women. Pediatr Infect Dis J 1995;14:921-922. 23. Zuccotti GV, Ribero ML, Giovannini M, Fasola M, Riva E, Portera G, Biasucci G, et al. Effect of hepatitis C genotype on mother-to-infant transmission of virus. J Pediatr 1995;127:278-280. 24. Tovo PA, Palomba E, Ferraris G, Principi N, Ruga E, Dallacasa P, Maccabruni A. Increased risk of maternal-infant hepatitis C virus transmission for women coinfected with human immunodeficiency virus type 1. Italian Study Group for HCV Infection in Children. Clin Infect Dis1997;25:1121-1124. 25. Zanetti AR, Tanzi E, Romano L, Zuin G, Minola E, Vecchi L, Principi N.A prospective study on mother-to-infant transmission of hepatitis C virus. Intervirology 1998;41:208-212. 26. Paccagnini S, Principi N, Massironi E, Tanzi E, Romano L, Muggiasca ML, Ragni MC, et al. Perinatal transmission and manifestation of hepatitis C virus infection in a high risk population. Pediatr Infect Dis J 1995;14:195-199. 27. Mazza C, Ravaggi A, Rodella A, Padula D, Duse M, Lomini M, Puoti M, et al. Prospective study of mother-to-infant transmission of hepatitis C virus (HCV) infection. Study Group for Vertical Transmission. J Med Virol 1998;54:12-19. 28. Gussetti N, Rampazzo G, Bortolotti F, Cadrobbi P. HCV infection in the mother and hepatitis C in the infant. Giornale Italiano di Malattie Infettive 1998;4(Suppl 1):S47-S50. 29. Alter MJ, Kruszon-Moran D, Nainan OV, McQuillan GM, Gao F, Moyer LA, Kaslow RA, et al. The prevalence of hepatitis C virus infection in the United States, 1988 through 1994. N Engl J Med 1999;341:556-562. 30. Di Giulio A, Barabcini I, Bianchi P, Goldoni E, Leonetti G, D’Errico D, De Sanctis G, et al. Transmission of HCV from infected mothers to their offsprings. Giornale di Malattie Infettive e Parassitarie 1994;46:674-679. 31. Resti M, Azzari C, Lega L, Rossi ME, Zammarchi E, Novembre E, Vierucci A. Mother-to-infant transmission of hepatitis C virus. Acta Paediatr 1995;84:251-255. 32. Sabatino G, Ramenghi LA, di Marzio M, Pizzigallo E. Vertical transmission of hepatitis C virus: an epidemiological study on 2,980 pregnant women in Italy. Eur J Epidemiol 1996;12:443-447. 33. Okamoto M, Nagata I, Murakami J, Kaji S, Iitsuka T, Hoshika T, Matsuda R, et al. Prospective reevaluation of risk factors in mother-to-child transmission of hepatitis C virus: high virus load, vaginal delivery, and negative anti-NS4 antibody. J Infect Dis 2000;182:1511-1514. 34. Ruiz-Extremera A, Salmeron J, Torres C, De Rueda PM, Gimenez F, Robles C, Miranda MT. Follow-up of transmission of hepatitis C to babies of human immunodeficiency virus-negative women: the role of breast-feeding in transmission. Pediatr Infect Dis J 2000;19:511-516. 35. Resti M, Azzari C, Mannelli F, Moriondo M, Novembre E, de Martino M, Vierucci A. Mother to child transmission of hepatitis C virus: prospective study of risk factors and timing of infection in children born to women seronegative for HIV-1. Tuscany Study Group on Hepatitis C Virus Infection. BMJ 1998;317:437-441. 36. Papaevangelou V, Pollack H, Rochford G, Kokka R, Hou Z, Chernoff D, Hanna B, et al. Increased transmission of vertical hepatitis C virus (HCV) infection to human immunodeficiency virus (HIV)-infected infants of HIV– and HCV-coinfected women. J Infect Dis 1998;178:1047-1052. 37. La Torre A, Biadaioli R, Capobianco T, Colao MG, Monti M, Pulli F, Visioli CB, et al. Vertical transmission of HCV. Acta Obstet Gynecol Scand 1998;77:889-892. 38. Conte D, Fraquelli M, Prati D, Colucci A, Minola E. Prevalence and clinical course of chronic hepatitis C virus (HCV) infection and rate of HCV vertical transmission in a cohort of 15,250 pregnant women. HEPATOLOGY 2000;31:751-755. 39. Pipan C, Amici S, Astori G, Ceci GP, Botta GA. Vertical transmission of hepatitis C virus in low-risk pregnant women. Eur J Clin Microbiol Infect Dis 1996;15:116-120. 40. Moriya T, Sasaki F, Mizui M, Ohno N, Mohri H, Mishiro S, Yoshizawa H. Transmission of hepatitis C virus from mothers to infants: its frequency and risk factors revisited. Biomed Pharmacother 1995;49:59-64. 41. Ketzinel-Gilad M, Colodner SL, Hadary R, Granot E, Shouval D, Galun E. Transient transmission of hepatitis C virus from mothers to newborns. Eur J Clin Microbiol Infect Dis 2000;19:267-274. 42. Giacchino R, Tasso L, Timitilli A, Castagnola E, Cristina E, Sinelli N, Gotta C, et al. Vertical transmission of hepatitis C virus infection: usefulness of viremia detection in HIV-seronegative hepatitis C virus-seropositive mothers. J Pediatr 1998;132:167-169. 43. Casanovas Lax J, Silva Garcia G, Vargas Romero J, Nogales Perez MC, Aguayo Maldonado J, Cruz Guerrero G, Gonzalez Hachero J. [Vertical transmission of hepatitis C virus]. An Esp Pediatr 1997;47:627-632. 44. Thomas DL, Villano SA, Riester KA, Hershow R, Mofenson LM, Landesman SH, Hollinger FB, et al. Perinatal transmission of hepatitis C virus from human immunodeficiency virus type 1-infected mothers. Women and Infants Transmission Study. J Infect Dis 1998;177:1480-1488. 45. Ohto H, Terazawa S, Sasaki N, Hino K, Ishiwata C, Kako M, Ujiie N, et al. Transmission of hepatitis C virus from mothers to infants. The Vertical Transmission of Hepatitis C Virus Collaborative Study Group. N Engl J Med 1994;330:744-750. 46. Matsubara T, Sumazaki R, Takita H. Mother-to-infant transmission of hepatitis C virus: a prospective study. Eur J Pediatr 1995;154:973-978. 47. Kumar RM, Shahul S. Role of breast-feeding in transmission of hepatitis C virus to infants of HCV-infected mothers. J Hepatol 1998;29:191-197. 48. Roca-Gonzalez A, Fortuny C, Ercilla G, Coll O, Torne A, Jimenez R. Vertical transmission of the hepatitis C virus (HCV). A prospective study in 40 newborns of HCV-positive mothers. Pediatria Catalana 1996;56:77-81. 49. Kassem A, El-Nawawy A, Massoud N, El-Nazar SA, Sobhi E. Prevalence of hepatitis C virus (HCV) infection and its vertical transmission in Egyptian pregnant women and their newborns. J Tropical Pediatrics 2000;46:231-233. 50. Agha S, Sherif LS, Allam MA, Fawzy M. Transplacental transmission of hepatitis C virus in HIV-negative mothers. Res Virol 1998;149:229-234. 51. Aizaki H, Saito A, Kusakawa I, Ashiwara Y, Nagamori S, Toda G, Suzuki T, et al. Mother-to-child transmission of a hepatitis C virus variant with an insertional mutation in its hypervariable region. J Hepatol 1996;25:608-613. 52. Croxson M, Couper A, Voss L, Groves D, Gunn T. Vertical transmission of hepatitis C virus in New Zealand. N Z Med J 1997;110:165-167. 53. Fukuda K, Kuroki T, Nishiguchi S, Ogita S, Ueda T, Tubakio Y, Murata R, et al. [Mother-to-infant transmission of HCV]. Nippon Rinsho 1995; 53(Suppl):407-412. 54. Kage M, Ogasawara S, Kosai K, Nakashima E, Shimamatsu K, Kojiro M, Kimura A, et al. Hepatitis C virus RNA present in saliva but absent in breast-milk of the hepatitis C carrier mother. J Gastroenterol Hepatol 1997;12:518-521. 55. Kumar RM, Frossad PM, Hughes PF. Seroprevalence and mother-to-infant transmission of hepatitis C in asymptomatic Egyptian women. Eur J Obstet Gynecol Reprod Biol 1997;75:177-182. 56. Lin H, Kao J, Hsu H, Ni Y, Yeh S, Hwang L, Chang M, et al. Possible role of high-titer maternal viremia in perinatal transmission of hepatitis C virus. J Infect Dis 1994;169:638-641. 57. Meisel H, Reip A, Faltus B, Lu M, Porst H, Wiese M, Roggendorf M, et al. Transmission of hepatitis C virus to children and husbands by women infected with contaminated anti-D immunoglobulin. Lancet 1995;345: 1209-1211. 58. Menendez C, Sanchez-Tapias JM, Kahigwa E, Mshinda H, Costa J, Vidal J, Acosta C, et al. Prevalence and mother-to-infant transmission of hepatitis viruses B, C, and E in Southern Tanzania. J Med Virol 1999;58:215-220. 59. Minola E, Persiani P, Amuso G. Clinical features of hepatitis C virus (HCV) infection in pregnancy. Int J Gyne Obstet 1997;58:245-246. 60. Molesini M, Cinquetti M, Dolci L, Barlocco EG, Marchi D, Vinco A, Zoppi G. [Prevalence of HCV antibodies and vertical transmission of hepatitis C virus]. Pediatr Med Chir 1996;18:43-45. 61. Polatti F, Viazzo F, Colleoni R, Belloni C, Zara F. Vertical transmission of hepatitis C virus and follow-up of newborns from infected mothers. Minerva Ginecol 2000;52:59-62. 62. Power JP, Davidson F, O’Riordan J, Simmonds P, Yap PL, Lawlor E. Hepatitis C infection from anti-D immunoglobulin. Lancet 1995;346:372-373. 63. Sasaki N, Matsui A, Momoi M, Tsuda F, Okamoto H. Loss of circulating hepatitis C virus in children who developed a persistent carrier state after mother-to-baby transmission. Pediatr Res 1997;42:263-267. 64. Tanzi M, Bellelli E, Benaglia G, Cavatorta E, Merialdi A, Mordacci E, Ribero ML, et al. The prevalence of HCV infection in a cohort of pregnant women, the related risk factors and the possibility of vertical transmission. Eur J Epidemiol 1997;13:517-521. 65. Xiong SK, Okajima Y, Ishikawa K, Watanabe H, Inaba N. Vertical transmission of hepatitis C virus: risk factors and infantile prognosis. J Obstet Gynaecol Res 1998;24:57-61. 66. Wejstal R, Manson A, Widell A, Norkrans G. Perinatal transmission of hepatitis G virus (GB virus type C) and hepatitis C virus infections—a comparison. Clin Infect Dis 1999;28:816-821. 67. Palomba E, Manzini P, Fiammengo P, Maderni P, Saracco G, Tovo PA. Natural history of perinatal hepatitis C virus infection. Clin Infect Dis 1996;23:47-50. 68. Uehara S, Abe Y, Saito T, Yoshia Y, Wagatsuma S, Okamura K, Yajima A, et al. The incidence of vertical transmission of hepatitis C virus. Tohoku J Exp Med 1993;171:195-202. 69. Koseki S, Taga M, Aoyama M, Hirabuki T, Hirahara F, Takahasi T, Minaguchi H, et al. Mother-to-infant transmission of hepatitis C virus in human immunodeficiency virus-coinfected mother: a case report. J Obstet Gynaecol Res 1996;22:139-142. 70. Minola E, Tambini R, Bertuletti P, Amuso G, Pasinetti G, Vicari O, Perani V, et al. Trasmissione verticale del virus dell’epatite C: studio prospettico. In: Giornale Italiano di Malattie Infettive 1997;229-233. 71. Ni YH, Lin HH, Chen PJ, Hsu HY, Chen DS, Chang MH. Temporal profile of hepatitis C virus antibody and genome in infants born to mothers infected with hepatitis C virus but without human immunodeficiency virus coinfection. J Hepatol 1994;20:641-645. 72. Incandela L, Carli T, Giomi S, Bonazza P, Nencioni C, Riccardi M, Caudai C, et al. Perinatal transmission of hepatitis C virus. Giornale di Malattie Infettive e Parassitarie 1994;46:906-908. 73. Farmaki G, Papaevangelou V, Kada E, Papevangelou G. Vertical transmission of hepatitis C virus. Arch Hellenic Med 1999;16:249-252. 74. Polywka S, Feucht H, Zollner B, Laufs R. Hepatitis C virus infection in pregnancy and the risk of mother-to-child transmission. Eur J Clin Microbiol Infect Dis 1997;16:121-124. 75. Tovo P, Pembrey L, Newell M. Persistence Rate and Progression of Vertically Acquired Hepatitis C Infection. J Inf Dis 2000;181:419-424. 76. Vogt M, Lang T, Frosner G, Klingler, Sendl A, Zeller A, Wiebecke B, et al. Prevalence and clinical outcome of hepatitis C infection in children who underwent cardiac surgery before the implementation of blood-donor screening. N Engl J Med 1999;341:866-870. 77. Roberts EA, King SM, Fearon M, McGee N. Hepatitis C in children after transfusion: assessment by look-back studies. Acta Gastroenterol Belg 1998;61:195-197. 78. Yokosuka O, Kojima H, Imazeki F, Taawa M, Saisho H, Tamatsukuri S, Omata M. Spontaneous negativation of serum hepatitis C virus RNA is a rare event in type C chronic liver diseases: analysis of HCV RNA in 320 patients who were followed for more than 3 years. J Hepatol 1999;31:394-399. 79. Ghisetti V, Barbui A, Varetto S, Chiaberge E, Coscia A, Farinasso D, Bandelloni A. Neonatal transmission of hepatitis C virus infection: experience in a group of mother-to-infant positive anti-HCV. Microbiologia Medica 1997;12:358-359. 80. Catalano D, Pollio F, Ercolano S, Ascione L, Desantis B, Russo C. [Maternal-fetal transmission of HCV. Role of HIV as a risk factor]. Minerva Ginecol 1999;51:117-119. 81. Bellu D, GGerulewicz D, Sagliarini G, Franchina M. Mother to infant transmission of hepatitis C virus. Ital J Gynaecol Obstet 1999;11:22-24. 82. de Martino M, Azzari C, Resti M, Moriondo M, Rossi ME, Galli L, Vierucci A. Hepatitis G virus infection in human immunodeficiency virus type 1-infected mothers and their children. J Infect Dis 1998;178:862-865. 83. Manzini P, Saracco G, Cerchier A, Riva C, Musso A, Ricotti E, Palomba E, et al. Human immunodeficiency virus infection as risk factor for mother-to– child hepatitis C virus transmission; persistence of anti-hepatitis C virus in children is associated with the mother’s anti-hepatitis C virus immunoblotting pattern. HEPATOLOGY 1995;21:328-332. 84. Martinetti M, Pacati I, Daielli C, Salvaneschi L, Maccabruni A. Critical role of Val/Gly86 HLA-DRB dimorphism in the neonatal resistance or susceptibility to maternal hepatitis C virus infection. Pediatr Infect Dis J 1997;16:1001-1002. 85. Nigro G, D’Orio F, Catania S, Badolato MC, Livadiotti S, Bernardi S, D’Argenio P. Mother to infant transmission of coinfection by human immunodeficiency virus and hepatitis C virus: prevalence and clinical manifestations. Arch Virol 1997;142:453-457. 86. Valle C, Lavagne G, Corona D, Valle P, Richero P, Garuti A, Venturino V, et al. Malattie a trasmissione verticale: dallo screening alla biologia molecolare. La Transfusione Del Sangue 1999;44:189-195. 87. Kurauchi O, Furui T, Itakura A, Ishiko H, Sugiyama M, Ohno Y, Ando H, et al. Studies on transmission of hepatitis C virus from mother-to-child in the perinatal period. Arch Gynecol Obstet 1993;253:121-126. 88. Kuroki T, Nishiguchi S, Fukuda K, Ikeoka N, Murata R, Isshiki G, Tomoda S, et al. Vertical transmission of hepatitis C virus (HCV) detected by HCV-RNA analysis. Gut 1993:S52-S53. 89. Koseki S. [Mother-to-infant transmission of hepatitis C virus]. Nippon Sanka Fujinka Gakkai Zasshi 1994;46:1322-1328. 90. Nakashima K, Ikematsu H, Hayashi J, Kishihara Y, Mutsutake A, Kashiwagi S. Intrafamilial transmission of hepatitis-C virus among the population of an endemic area of Japan. JAMA 1995;274:1459-1461. 91. Saitoh A, Miyamura T. [Mother to child transmission of HCV—from the analysis of the nucleotide sequence]. Nippon Rinsho 1995;53:S419-S422. 92. Kojima T, Yamanaka T. [Transmission routes of hepatitis C virus: analysis of anti-HCV-positive pregnant women and their family members]. Nippon Sanka Fujinka Gakkai Zasshi 1994;46:573-580. 93. Hillemanns P, Dannecker C, Kimmig R, Hasbargen U. Obstetric risks and vertical transmission of hepatitis C virus infection in pregnancy. Acta Obstetricia et Gynecologica Scandinavica 2000;79:543-547. 94. Reinus J, Leikin E, Alter H, Cheung L, Shindo M, Jett B, Piazza S, et al. Failure to detect vertical transmission of hepatitis C virus. Ann Int Med 1992;117:881-886. 95. Cilla G, Perez-Trallero E, Iturriza M, Carcedo A, Echeverria J. Maternal-Infant Transmission of hepatitis C virus infection. Ped Inf Dis J 1992; 11:417. 96. Fischler B, Lindh G, Lindgren S, Forsgren M, Von Sydow M, Sangfelt P, Alaeus A, et al. Vertical transmission of hepatitis C virus infection. Scand J Infect Dis 1996;28:353-356. 97. Kudesia G, Ball G, Irving WL. Vertical transmission of hepatitis C. Lancet 1995;345:1122. 98. Delamare C, Carbonne B, Heim N, Berkane N, Petit J, Uzan S, Grange J. Detection of hepatitis C virus RNA (HCV RNA) in amniotic fluid: a prospective study. J Hepatol 1999;31:416-420. 99. Gervais A, Bacq Y, Bernuau J, Martinot M, Auperin A, Boyer N, Kilani A, et al. Decrease in serum ALT and increase in serum HCV RNA during pregnancy in women with chronic hepatitis C. J Hepatol 2000;32:293-299. 100. Marcellin P, Bernuau J, Martinot-Peignoux M, Larzul D, Xu LZ, Tran S, Bezeaud A, et al. Prevalence of hepatitis C virus infection in asymptomatic anti-HIV1 negative pregnant women and their children. Dig Dis Sci 1993;38:2151-2155. 101. Roudot-Thoraval F, Pawlotsky JM, Thiers V, Deforges L, Girollet PP, Guillot F, Huraux C, et al. Lack of mother-to-infant transmission of hepatitis C virus in human immunodeficiency virus-seronegative women: a prospective study with hepatitis C virus RNA testing. HEPATOLOGY 1993;17:772-777. 102. Lin HH, Kao JH, Hsu HY, Ni YH, Chang MH, Huang SC, Hwang LH, et al. Absence of infection in breast-fed infants born to hepatitis C virus-infected mothers. J Pediatr 1995;126:589-591. Источник: http://hepatit.ru/reviews/verthcv.htm См. информацию о гепатитах для врачей и пациентов _____________См. также научные статьи, переводы совеменной научной периодики, диссертации в разделе "Врачам"
, 10.07.2004
|
||||||||||||||||||||||||||||||||||||||||||||||